2021年6月27日,朱国萍教授团队在世界顶级分子进化生物学杂志《Molecular Biology and Evolution》(影响因子=16.24)发表题为《Identification of a Novel Class of Photolyases as Possible Ancestors of Their Family》的研究论文,朱国萍教授为该论文通讯作者,皖南医学院徐蕾教授为第一作者。
光修复酶(photolyase)被认为是最早出现的参与DNA修复的蛋白之一,它可以通过光修复途径,即利用阳光中的蓝色光(400-500 nm)和长波紫外线(UVA, 315-400 nm)作为能源,直接有效的修复DNA损伤。与光修复酶古老的进化历史相应的是,光修复酶基因在所有生物界中广泛分布,甚至一些病毒中也有发现。
在远古无氧条件下,地球缺乏臭氧层的保护,紫外线到达地面的强度远强于现在的水平。光修复酶作为一种古老的DNA修复蛋白,可能在原始生命体的DNA修复过程中发挥重要作用。此前,学术界普遍认为,一种来自原核生物的FeS-BCP(Fe-S Bacterial Cryptochromes and Photolyases)蛋白因具有铁硫簇等原始特征,是光修复酶家族最古老的成员。然而,此观点的问题在于,FeS-BCP是一种6-4光修复酶,不能修复DNA紫外损伤的主要成分——CPD损伤,因而不足以使原始生命体存活下来。
该论文通过详实的系统发生分析,从270个物种的574条光修复酶家族蛋白序列中,发现了该家族中一类新成员—SPL(Short Photolyase-Like)。论文对SPL蛋白的序列和结构进行了生物信息学分析,发现该类蛋白具有与CPD光修复酶类似的底物结合区和FAD辅酶结合区,但缺乏正常光修复酶N端的α/β结构域,部分SPL还可能具有形成铁硫簇的能力。论文进而对来自束红球菌(Rhodococcus fascians)中具有代表性的SPL蛋白进行了克隆表达和性质研究,证明该蛋白结合有FAD辅酶,具有CPD损伤修复能力,且具有铁硫簇。根据结果,论文推测SPL蛋白才是光修复酶家族中最原始的成员,此观点受到审稿专家的一致认可。
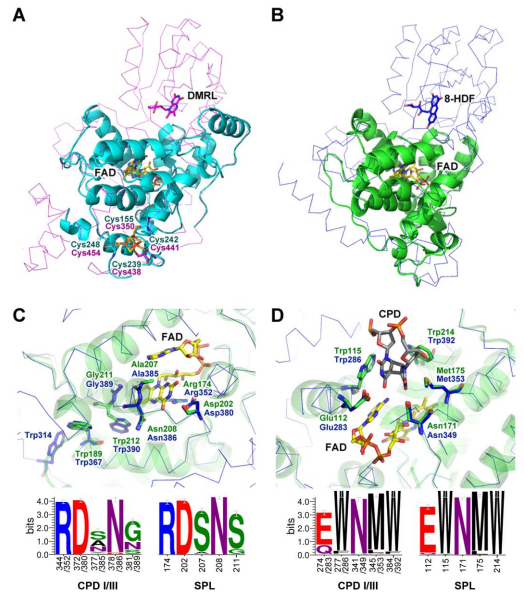
代表性SPL蛋白结构及功能位点
朱国萍教授团队于2010年开始开展光修复酶的功能与进化研究,至今已有11年。徐蕾教授曾是朱国萍教授的博士生,其论文《从热不稳定到光不稳定─光修复酶性质及其与隐色素分子进化关系》被评为安徽师范大学优秀博士学位论文。徐蕾教授现为朱国萍教授创新团队及其劳模创新工作室成员。该团队已在《Molecular Biology and Evolution》、《ChemBioChem》、《Journal of Photochemistry and Photobiology B》等国际期刊发表系列论文。该项研究是朱国萍教授团队在进化分子生物学方向研究的又一次重大突破,对于认识光修复酶家族的功能和进化具有重要意义,同时对于地球生命的起源与演化研究也具有一定的价值。
论文链接https://academic.oup.com/mbe/advance-article/doi/10.1093/molbev/msab191/6310176
 最新更新
最新更新