近日,在国家自然科学基金和安徽省高峰学科建设的支持下,化学与材料科学学院功能共轭分子科研团队郝二红、焦莉娟教授,联合大连理工大学张新富、肖义教授在最新一期《美国化学会志》发表题为“Long-Wavelength Photoconvertible Dimeric BODIPYs for Super-Resolution Single-Molecule Localization Imaging in Near-Infrared Emission”的学术论文(J. Am. Chem. Soc.2022, 144, 21992–21999)(https://doi.org/10.1021/jacs.2c08947)。
功能共轭分子团队一直围绕含硼多吡咯染料的构建和应用开展研究,在前期双激子耦合的乙烯桥联氮杂BODIPY二聚体(Unique Double Intramolecular and Intermolecular Exciton Coupling in Ethene-Bridged aza-BODIPY Dimers for High-Efficiency Near-Infrared Photothermal Conversion and Therapy,Angew. Chem. Int. Ed.2022,61, e202211081)和B(III)-单氮杂亚卟啉(Boron-Templated Synthesis of B(III)-Submonoazaporphyrins: The Hybrids of B(III)-Subporphyrinsand B(III)-Subporphyrazines,J. Am. Chem. Soc.2022,144, 6692-6697)的研究基础上,该团队发展了一类全新的基于亚砜桥联BODIPY二聚体的光转换荧光团。在可见光激活下,这类亚砜桥联BODIPY二聚体光转换荧光团发生高效的、不可逆地分子内消除亚砜(SO)物种以生成相应的α,α-直接连接的BODIPY二聚体。这种新的光激活转化机制扩展了细胞内光转换探针的工具箱,为发展超分辨率单分子定位成像的有机小分子荧光团的设计合成提供了一种新的通用策略。

超分辨率成像技术,如单分子定位显微镜,克服了衍射分辨率的限制,在过去二十年中已成为以纳米级分辨率可视化细胞结构的独特工具。虽然光活化/转换荧光蛋白极大地促进了SMLM技术的发展,但由于其尺寸大,不希望的过表达或寡聚/聚集以及掺入受限,因而其应用仍然受到限制。光转换有机荧光团,它可以从一种荧光发射波长转化为另一种发射波长,从而使活化前和活化后形式的可视化,因此在活细胞成像的高时间和空间分辨率方面具有潜在的优势。
然而,到目前为止,小分子光转换荧光探针仍然很少,而且通常其光转化过程效率低,需要使用紫外光照射和细胞毒性添加剂以及氧气参与。在这项工作中,团队成功发展了一类亚砜桥联BODIPY二聚体作为一种新型的长波长可激活的光转换荧光团。机理研究发现两个相邻BODIPY基团的紧密正交排列所诱导的高效系间穿越为这种光转化过程带来了所需的三重态中间体。通过这种光转换,探针不仅实现了超过100nm的最大吸收和发射峰红移,而且高效地产生了具有明亮近红外荧光的稳定产物(最大吸收/射峰高达648/714nm)。这种光激活和红移激发/发射的组合为细胞成像提供了高对比度并消除了生物自发荧光的干扰。因此,这种新的光激活光转换可以在无需紫外线照射和细胞毒性添加剂的情况下实现对活细胞超分辨率单分子定位成像。
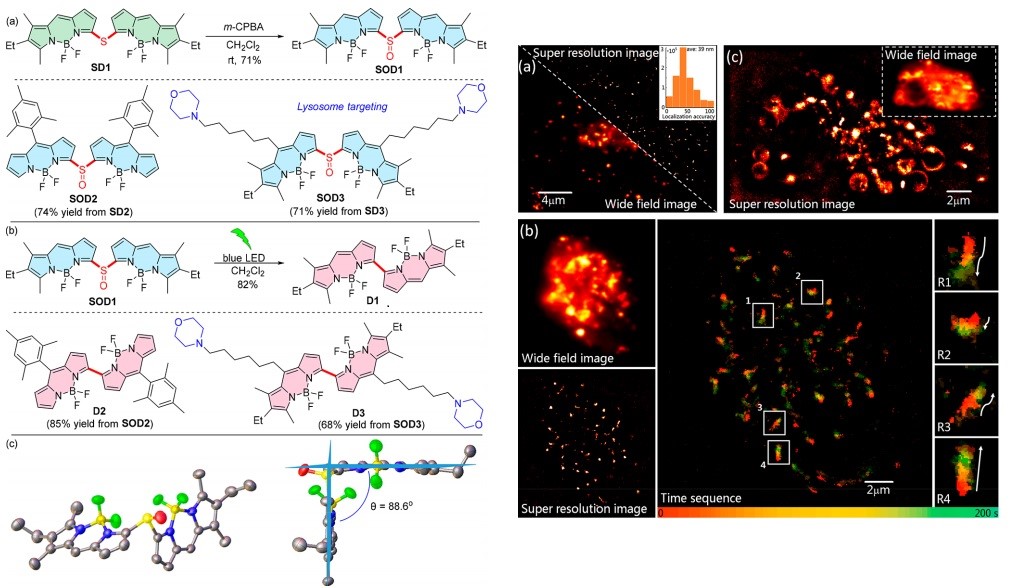
团队进一步以含有溶酶体靶向吗啉部分的探针SOD3为例,展示了这些新型光转换荧光团在活细胞亚细胞器单分子定位成像中的潜在应用,实现了定位精度约为39 nm的HeLa细胞中球状溶酶体的单分子定位成像,并进一步利用单分子定位成像来追踪了疾病模型中的溶酶体病变过程。
安徽师范大学为论文第一单位,化学与材料科学学院功能共轭分子科研团队郝二红、焦莉娟教授和大连理工大学张新富、肖义教授为共同通讯稿作者,文章的第一作者是安徽师范大学2022届毕业研究生宫清宝博士。
 最新更新
最新更新